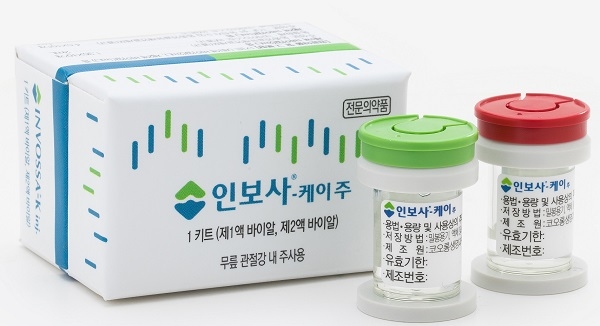
[이지경제] 김주경 기자 = 코오롱생명과학이 개발한 골관절염 치료제 ‘인보사케이주(이하 인보사)’가 위암 등 종양 관련 부작용을 포함한 기타 보고접수가 329건에 이르는 것으로 집계됐다. 그럼에도 불구하고 식품의약품안전처는 환자 추적이나 관리 등 역학조사를 실시하지 않은 것으로 드러났다.
4일 정춘숙 의원(보건복지위원회 소속)이 식품의약품안전처로부터 받은 자료에 따르면 지난 2014년부터 올해 8월 중순까지 인보사 관련 총 329건의 부작용이 있었던 것으로 확인됐다.
이 가운데 종양 관련은 총 8건이었다. 종양 종류는 △악성자궁내막신생물 △위암종 2건 △췌장암 △간신생물 △여성악성유방신생물 △악성자궁내막신생물 △이차암종 등이다.
앞서 인보사는 주요 성분인 ‘연골세포’가 암을 유발하는 ‘신장세포’로 바꿔치기한 사실이 드러났다. 이에 식약처는 지난 5월 판매허가를 취소한 바 있다.
아울러 ‘효과 없다’고 보고된 사례도 총 63건(19.1%) 이었다.
인보사 외 다른 무릎(슬관절) 주사제에 대한 이상반응 가운데 효과가 없다고 나온 치료제 (10.7%) 대비 2배 가량 높았다는 것.
정춘숙 의원은 “이보다 더 충격적인 것은 인보사 관련 암 부작용 사례가 8건이나 나왔음에도 식약처가 역학조사조차 실시하지 않았다”고 주장했다.
정춘술 의원실에 따르면 종양 관련 부작용 8건에 대한 역학조사 등이 이뤄지고 있는지 확인한 결과 식약처로부터 역학조사를 진행하지 않았다는 답변을 받았다.
종양 관련 이상사례에 대해서는 원보고자의 평가결과 가능성 낮음, 평가곤란, 평가불가로 보고돼 현재까지 역학조사는 진행하고 있지 않다는 것이 식약처 측의 설명이다.
아울러 역학조사를 실시하지 않은 배경을 계속 추궁하자 그제서야 식약처가 전체적인 재검증을 지시했다는 것.
정춘숙 의원은 “현재까지는 인보사케이주가 현재까지는 허가 시 독성자료와 방사선조사 등을 종합적으로 검토한 결과 큰 우려가 없다는 것이 전문가의 판단”이라며 “그럼에도 투여환자 등록 및 15년 간 장기추적조사 등 특별 관리를 실시하는 이유가 종양유발 가능성이 있는 신장세포 때문인 데 위암 등 종양 관련 보고가 이뤄졌에도 식약처가 역학조사조차 실시하지 않았다는 문제가 있다”고 지적했다.
이어 “인보사는 실제로 많은 환자에게 투여된 만큼 부작용 보고 시 역학조사 등 식약처의 더욱 적극적인 환자안전관리 대책이 필요하다”고 강조했다.
김주경 기자 ksy055@ezyeconomy.com